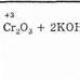Razdelki spletnega mesta
Izbira urednika:
- Vir ognjene soli v Skyrimu
- Kako in kje najti Lydijo v Skyrimu, če se izgubi?
- Prehod naloge Focus Oculatory v Skyrimu
- Dediščine Skyrim Companions dodatne naloge
- Stranske misije Optimalna prikrita kombinacija za premagovanje Mr. Freezea v Batmanu: Arkham City
- Vodenje za sopotnike
- Zakaj sanjati o jami "Na obrazu" grozno, prijazno v notranjosti
- Skyrim - Edino zdravilo (prehod)
- Vodenje College of Winterhold The Elder Scrolls V: Skyrim
- College of Winterhold uničenja
Oglaševanje
| Kromov oksid: formula, značilnosti in kemijske lastnosti. Krom in njegove spojine Proizvodnja kromovega oksida in hidroksida 2 |
|
] molekuli CrO so dodeljeni številni R-senčeni pasovi, opaženi v območju 4800 – 7100 Å v emisijskem spektru električnega loka v zraku, ko je vanj nameščen kovinski krom ali Cr 2 Cl 6 sol. Vibracijska analiza je pokazala, da pasovi pripadajo istemu sistemu (elektronski prehod) s pasom 0-0 pri približno 6000 Å, določene so bile vibracijske konstante zgornjega in spodnjega elektronskega stanja. "oranžnem" sistemu so dodeljeni tudi pasovi v območju 7100 – 8400 Å, merjeno v [32FER]. V [55NIN] je bila izvedena delna analiza rotacijske strukture pasov, na podlagi katere je bil ugotovljen tip elektronskega prehoda 5 Π - 5 Π. V priročniku [84HUG/GER] je spodnje stanje sistema označeno kot osnovno stanje molekule X 5 Π. Celotno rotacijsko analizo petih pasov sistema (2-0, 1-0, 0-0, 0-1 in 0-2) smo izvedli v [80HOC/MER]. Pasovi so bili posneti z visoko ločljivostjo v emisijskem spektru razelektritve in v spektru laserskega vzbujanja molekul CrO v toku inertnega nosilnega plina. Nižje stanje sistema je bilo potrjeno kot osnovno stanje molekule (spekter laserskega vzbujanja je bil pridobljen pri temperaturi nosilnega plina tik pod sobno temperaturo). Še en šibkejši sistem pasov CrO je bil ugotovljen v emisijskem spektru razelektritve v bližnjem infrardečem območju [84CHE/ZYR]. Spekter smo dobili s Fourierjevim spektrometrom. Rotacijska analiza pasu 0-0, ki se nahaja blizu 8000 cm -1, je pokazala, da sistem pripada prehodu 5 Σ - X 5 Π. Tretji sistem pasov CrO s središčem približno 11800 cm -1 je bil ugotovljen v kemiluminiscenčnem spektru med reakcijo atomov kroma z ozonom [89DEV/GOL]. Pasovi tega sistema so označeni tudi v atlasu [57GAT/JUN]. V [93BAR/HAJ] sta bila pasova 0-0 in 1-1 pridobljena z visoko ločljivostjo v spektru laserskega vzbujanja. Izvedena je bila rotacijska analiza, ki je pokazala, da je sistem nastal s prehodom 5 Δ - X 5 Π. V kemiluminiscenčnem spektru [89DEV/GOL] smo našli sistem pasov v območju 4510 Å (ν 00 = 22163 cm -1) in izvedli vibracijsko analizo. Sistem verjetno pripada elektronskemu prehodu s prenosom naboja, saj vibracijski interval v zgornjem stanju je veliko manjši od vibracijskih intervalov v drugih stanjih CrO. Predelektronski prehod je označen kot C 5 Π - X 5 Π. Fotoelektronski spektri CrO - aniona so bili pridobljeni v [96WEN/GUN] in [2001GUT/JEN]. Najbolj popolna in zanesljiva interpretacija spektrov, ki temelji na izračunu MRCI aniona in molekule, je predstavljena v [2002BAU/GUT]. Glede na izračun ima anion osnovno stanje X 4 Π in prvo vzbujeno stanje 6 Σ + . Spektri prikazujejo enoelektronske prehode iz teh stanj v osnovno in 5 vzbujenih stanj nevtralne molekule: X 5 Π ← 6 Σ + (1,12 eV), X 5 Π ← X 4 Π (1,22 eV), 3 Σ – ← X 4 Π (1,82 eV), 5 Σ + ← 6 Σ + (2,13 eV), 3 Π ← X 4 Π (2,28 eV), 5 Δ ← 6 Σ + (2,64 eV), 3 Φ ← X 4 Π (3,03 Π eV). Energije stanj CrO kvinteta se ujemajo s podatki optičnih spektrov. Tripletnih stanj 3 Σ – (0,6 eV), 3 Π (1,06 eV) in 3 Φ (1,81 eV) nismo opazili v optičnih spektrih. Kvantno-mehanski izračuni CrO so bili izvedeni v [ 82GRO/WAH, 84HUZ/KLO, 85BAU/NEL, 85NEL/BAU, 87AND/GRI, 87DOL/WED, 88JAS/STE, 89STE/NAC, 95BAU/MAI/STI, 96 2000BRI /ROT, 2000GUT/RAO, 2001GUT/JEN, 2002BAU/GUT, 2003GUT/AND, 2003DAI/DEN, 2006FUR/PER, 2007JEN/ROO, 2007WAG/MIT]. Izračun [85BAU/NEL] je pokazal in potrdil v poznejših izračunih, da je osnovno stanje molekule 5 Π. Energije vzbujenih stanj so podane neposredno ali posredno (v obliki disociacijske energije ali afinitete elektronov) v [85BAU/NEL, 85NEL/BAU, 96BAK/STI, 2000BRI/ROT, 2001GUT/JEN, 2002BAU/GUTDAI/20D ]. V izračun termodinamičnih funkcij smo vključili: a) spodnjo komponento Ω = -1 stanja X 5 Π, kot glavno stanje; b) preostale Ω-komponente X 5 Π kot ločena vzbujena stanja; c) vzbujena stanja, katerih energije se določijo eksperimentalno ali izračunajo; d) sintetična stanja, ki upoštevajo vsa druga stanja molekule z ocenjeno energijo do 40.000 cm -1. Ravnotežne konstante za stanje X 5 Π CrO so bile pridobljene v [80HOC/MER]. V tabeli Cr.D1 so navedene kot konstante za spodnjo komponento X 5 Π –1, čeprav se nanašajo na celotno stanje kot celoto. Razlike v vrednostih ω e za komponente stanja X 5 Π so nepomembne in se upoštevajo v okviru napake ± 1 cm -1. Energije vzbujenih stanj so podane glede na spektroskopske podatke [ 84CHE/ZYR ] (5 Π 0 , 5 Π 1 , 5 Π 2 , 5 Π 3 , A 5 Σ +), [ 93BAR/HAJ ] ( A΄ 5 Δ), [ 80HOC/MER] (B 5 Π), [89DEV/GOL] (C 5 Π); interpretacija fotoelektronskih spektrov [ 2002BAU/GUT ] (3 Σ - , 3 Π, 3 Φ); glede na izračune [ 2002BAU/GUT ] (5 Σ – , 3 Δ) in [ 2003DAI/DEN ] (3 Σ). Vibracijske in rotacijske konstante vzbujenih stanj CrO niso bile uporabljene pri izračunih termodinamičnih funkcij in so za referenco podane v tabeli Cr.D1. Za države A 6 Σ + , A΄ 5 Δ, B 5 Π, C(5 Π) so spektroskopske konstante podane po podatkih [84CHE/ZYR, 93BAR/HAJ, 80HOC/MER, 89DEV/GOL]. Za stanja 3 Σ - , 3 Π, 3 Φ so podane vrednosti ω e, pridobljene iz fotoelektronskega spektra aniona v [96WEN/GUN]. Vrednosti ω e za stanja 5 Σ - , 3 Δ in r e za 3 Σ - , 3 Π, 3 Φ, 5 Σ - , 3 Δ so podani glede na rezultate izračuna MRCI [2002BAU/GUT]. Statistične uteži sintetičnih stanj so ocenjene z uporabo ionskega modela. Opazovana in izračunana stanja CrO so pripisana trem ionskim konfiguracijam: Cr 2+ (3d 4)O 2-, Cr 2+ (3d 3 4s)O 2- in Cr + (3d 5)O - . Energije drugih stanj teh konfiguracij smo ocenili s pomočjo podatkov [71MOO] o položajih členov eno in dvojno nabitih kromovih ionov. Uporabljene so tudi ocene [2001GUT/JEN] za energije 7 Π, 7 Σ + stanj Cr + (3d 5)O - konfiguracije. Termodinamične funkcije CrO(g) smo izračunali z enačbami (1.3) - (1.6) , (1.9) , (1.10) , (1.93) - (1.95) . Vrednote Q zn in njene izpeljanke smo izračunali z enačbami (1.90) - (1.92) ob upoštevanju devetnajstih vzbujenih stanj ob predpostavki, da Qšt.vr ( jaz) = (p i /p X)Qšt.vr ( X) . Vibracijsko-rotacijsko porazdelitveno funkcijo stanja X 5 Π -1 in njenih izpeljank smo izračunali z uporabo enačb (1.70) - (1.75) z neposrednim seštevanjem po vibracijskih nivojih in integracijo po nivojih rotacijske energije z uporabo enačbe, kot je (1.82). Izračuni so upoštevali vse energetske ravni z vrednostmi J< J max,v, kje J max,v je bil ugotovljen iz pogojev (1.81). Vibracijsko-rotacijske ravni stanja X 5 Π -1 smo izračunali z enačbami (1.65), vrednosti koeficientov Y kl v teh enačbah smo izračunali z uporabo razmerij (1.66) za izotopsko modifikacijo, ki ustreza naravni mešanici izotopov kroma in kisika iz molekulskih konstant 52 Cr 16 O, podanih v tabeli Cr.D1. Vrednosti koeficientov Y kl , kot tudi količine v max in J lim so podane v tabeli Cr.D2. Pri sobni temperaturi dobimo naslednje vrednosti: C p o (298,15 K) = 32,645 ± 0,26 J × K -1 × mol -1 S o (298,15 K) = 238,481 ± 0,023 J × K -1 × mol -1 H o (298,15 K) - H o (0) = 9,850 ± 0,004 kJ× mol -1 Glavni prispevek k napaki izračunanih termodinamičnih funkcij CrO(g) pri temperaturah 298,15 in 1000 K prihaja iz metode izračuna. Pri 3000 in 6000 K je napaka predvsem posledica negotovosti v energijah vzbujenih elektronskih stanj. Napake v vrednostih Φº( T) pri T= 298,15, 1000, 3000 in 6000 K so ocenjene na 0,02, 0,04, 0,2 oziroma 0,4 J× K -1 × mol -1. Prej so termodinamične funkcije CrO(g) za tabele izračunali JANAF [85CHA/DAV], Schneider [74SCH] (T = 1000 – 9000 K), Brewer in Rosenblat [69BRE/ROS] (vrednosti Φº( T) za T ≤ 3000 K). Neskladja med tabelami JANAF in tabelo. CrO pri nizkih temperaturah so posledica dejstva, da avtorji [85CHA/DAV] niso mogli upoštevati multiple cepitve stanja X 5 Π; neskladje v vrednostih Φº(298,15) je 4,2 J× K -1 × mol -1 . V območju 1000 – 3000 K so odstopanja v vrednostih Φº( T) ne presegajo 1,5 J× K -1 × mol -1 , vendar pri 6000 K dosežejo 3,1 J× K -1 × mol -1 zaradi dejstva, da v [ Več kemičnih spojin, sestavljenih iz dveh preprostih elementov - Cr in O - spada v razred anorganskih spojin - oksidov. Njihovo splošno ime je kromov oksid, nato pa je v oklepaju običajno označiti valenco kovine z rimskimi številkami. Druga imena in kemične formule:
Spojina, v kateri je kovina šestvalentna, je najvišji kromov oksid. To je trdna snov brez vonja, ki na videz je (v zraku se širijo zaradi močne higroskopnosti). Molska masa - 99,99 g / mol. Gostota pri 20 °C je 2,70 g/cm³. Tališče - 197 ° C, vrelišče - 251 ° C. Pri 0 ° C se 61,7 g / 100 raztopi v vodi, pri 25 ° C - 63 g / 100 ml, pri 100 ° C - 67,45 g / 100 ml. Oksid se raztopi tudi v žveplovi kislini (to je mešanica kroma, ki se uporablja v laboratorijski praksi za pomivanje kemičnih posode) in etilnem alkoholu, etil etru, ocetni kislini, acetonu. Pri 450 °C se razgradi na Cr2O3. Krom (VI) oksid se uporablja v procesu elektrolize (za pridobitev čistega kroma), za kromiranje pocinkanih izdelkov, pri elektrolitskem kromiranju, kot močno oksidacijsko sredstvo (za proizvodnjo indiga in izatina). Krom se uporablja za odkrivanje alkohola v izdihanem zraku. Interakcija poteka po shemi: 4CrO3 + 6H2SO4 + 3C2H5OH → 2Cr2(SO4)3 + 3CH3COOH + 9H2O. Na prisotnost alkohola kaže sprememba barve raztopine (obarva zeleno). Krom (VI) oksid je, tako kot vse spojine šestvalentnega Cr, močan strup (smrtonosni odmerek - 0,1 g). CrO3 zaradi svoje visoke aktivnosti ob stiku z njimi povzroči požar (z eksplozijami). Kljub nizki hlapnosti je višji kromov oksid nevaren pri vdihavanju, saj povzroča pljučnega raka. Ob stiku s kožo (tudi če jo kmalu odstranimo) povzroči draženje, dermatitis, ekcem in izzove razvoj raka. Oksid s tetravalentnim kromom CrO2 po videzu je trdna snov v obliki črnih tetraedričnih feromagnetnih kristalov. Kromov oksid 4 ima molsko maso 83,9949 g / mol, gostoto 4,89 g / cm³. Snov se topi, hkrati pa se razgradi, pri temperaturi 375 °C. Ne raztopi se v vodi. Uporablja se v magnetnih snemalnih medijih kot delovna snov. S priljubljenostjo CD-jev in DVD-jev se je uporaba krom(IV) oksida zmanjšala. Prvič ga je sintetiziral leta 1956 kemik EI DuPont Norman L. Cox z razgradnjo kromovega trioksida v prisotnosti vode pri temperaturi 640 °C in tlaku 200 MPa. Po licenci DuPont ga proizvaja Sony na Japonskem in BASF v Nemčiji. Kromov oksid 3 Cr2O3 je trdna fino kristalinična snov od svetlo do temno zelene barve. Molarna masa je 151,99 g/mol. Gostota - 5,22 g / cm³. Tališče - 2435 ° C, vrelišče - 4000 ° C. Lomni količnik čiste snovi je 2,551. Ta oksid je netopen v vodi, alkoholu, acetonu, kislini. Ker se njegova gostota približuje gostoti korunda, se uvaja v sestavke polirnih sredstev (na primer pasta GOI). Je eden od kromov, ki se uporablja kot pigment. Prvič so ga z uporabo skrivne tehnologije pridobili leta 1838 v obliki prozorne hidratizirane oblike. V naravi se pojavlja v obliki kromove železove rude FeO.Cr2O3. Dvovalentni kromov oksid je črna ali rdeča trdna snov s tališčem 1550 °C. Stopi se z razpadom. Molska masa - 67,996 g / mol. Rdeči krom (II) oksid ni piroforen, je pa ista črna snov piroforna. Prašek se na zraku spontano vname, zato ga lahko shranjujemo le pod plastjo vode, saj z njim ne sodeluje. Črni kromov oksid v čisti obliki je zelo težko dobiti. Za kromove okside z nižjo valenco so značilne bazične lastnosti, za oksid z večjo valenco pa kisle. Krom tvori tri okside: CrO, Cr 2 O 3 , CrO 3 . Kromov oksid (II) CrO - piroforni črni prah. Ima osnovne lastnosti. V redoks reakcijah se obnaša kot redukcijsko sredstvo: CrO dobimo z vakuumsko razgradnjo kromovega karbonila Cr(CO) 6 pri 300°C. Kromov oksid (III) Cr 2 O 3 - ognjevzdržni zeleni prah. Po trdoti je blizu korundu, zato ga uvajamo v sestavo polirnih sredstev. Nastane zaradi interakcije Cr in O 2 pri visoki temperaturi. V laboratoriju lahko s segrevanjem amonijevega dikromata pridobimo krom (III) oksid: (N -3 H 4) 2 Cr +6 2 O 7 \u003d Cr +3 2 O 3 + N 0 2 + 4H 2 O Krom (III) oksid ima amfoterne lastnosti. Pri interakciji s kislinami nastanejo kromove (III) soli: Cr 2 O 3 + 3H 2 SO 4 \u003d Cr 2 (SO 4) 3 + 3H 2 O Pri interakciji z alkalijami v talini nastanejo kromove (III) spojine - kromiti (v odsotnosti kisika): Cr 2 O 3 + 2NaOH \u003d 2NaCrO 2 + H 2 O Krom (III) oksid je netopen v vodi. V redoks reakcijah se krom (III) oksid obnaša kot redukcijsko sredstvo:
Kromov oksid (VI) CrO 3 - kromov anhidrid, je temno rdeči igličasti kristali. Ko se segreje na približno 200°C, se razgradi: 4CrO 3 \u003d 2Cr 2 O 3 + 3O 2 Zlahka topen v vodi, ki ima kisli značaj, tvori kromove kisline. S presežkom vode nastane kromova kislina H 2 CrO 4: CrO 3 + H 2 O \u003d H 2 CrO 4 Pri visoki koncentraciji CrO 3 nastane dikromova kislina H 2 Cr 2 O 7: 2CrO 3 + H 2 O \u003d H 2 Cr 2 O 7 ki, ko se razredči, postane kromova kislina: H 2 Cr 2 O 7 + H 2 O \u003d 2H 2 CrO 4 Kromove kisline obstajajo samo v vodni raztopini; nobena od teh kislin ni bila izolirana v prostem stanju. Vendar so njihove soli zelo stabilne. Krom (VI) oksid je močan oksidant: 3S + 4CrO 3 \u003d 3SO 2 + 2Cr 2 O 3 Oksidira jod, žveplo, fosfor, premog in se spremeni v Cr 2 O 3. CrO 3 dobimo z delovanjem presežka koncentrirane žveplove kisline na nasičeno vodno raztopino natrijevega dikromata: Na 2 Cr 2 O 7 + 2H 2 SO 4 \u003d 2CrO 3 + 2NaHSO 4 + H 2 O. močna strupenost kromovega oksida (VI). Krom je element stranske podskupine 6. skupine 4. obdobja periodnega sistema kemičnih elementov D. I. Mendelejeva z atomsko številko 24. Označen je s simbolom Cr (lat. Chromium). Preprosta snov krom je modrikasto bela trda kovina. Kemijske lastnosti kromaV normalnih pogojih krom reagira samo s fluorom. Pri visokih temperaturah (nad 600°C) sodeluje s kisikom, halogeni, dušikom, silicijem, borom, žveplom in fosforjem. 4Cr + 3O 2 – t° →2Cr 2 O 3 2Cr + 3Cl 2 – t° → 2CrCl 3 2Cr + N 2 – t° → 2CrN 2Cr + 3S – t° → Cr 2 S 3 V vročem stanju reagira z vodno paro: 2Cr + 3H 2 O → Cr 2 O 3 + 3H 2 Krom se raztopi v razredčenih močnih kislinah (HCl, H 2 SO 4) V odsotnosti zraka nastanejo soli Cr 2+, v zraku pa nastanejo soli Cr 3+. Cr + 2HCl → CrCl 2 + H 2 2Cr + 6HCl + O 2 → 2CrCl 3 + 2H 2 O + H 2 Prisotnost zaščitnega oksidnega filma na površini kovine pojasnjuje njegovo pasivnost glede na koncentrirane raztopine kislin - oksidantov. Kromove spojineKrom (II) oksid in krom(II) hidroksid sta bazična. Cr(OH) 2 + 2HCl → CrCl 2 + 2H 2 O Kromove (II) spojine so močna redukcijska sredstva; prehajajo v kromove (III) spojine pod delovanjem atmosferskega kisika. 2CrCl 2 + 2HCl → 2CrCl 3 + H 2 4Cr(OH) 2 + O 2 + 2H 2 O → 4Cr(OH) 3 kromov oksid (III) Cr 2 O 3 je zelen, v vodi netopen prah. Dobimo ga lahko s kalciniranjem kromovega (III) hidroksida ali kalijevega in amonijevega dikromata: 2Cr(OH) 3 – t° → Cr 2 O 3 + 3H 2 O 4K 2 Cr 2 O 7 – t° → 2Cr 2 O 3 + 4K 2 CrO 4 + 3O 2 (NH 4) 2 Cr 2 O 7 - t ° → Cr 2 O 3 + N 2 + 4H 2 O (reakcija vulkana) amfoterni oksid. Ko se Cr 2 O 3 zlije z alkalijami, sodo in kislinskimi solmi, dobimo kromove spojine z oksidacijskim stanjem (+3): Cr 2 O 3 + 2NaOH → 2NaCrO 2 + H 2 O Cr 2 O 3 + Na 2 CO 3 → 2NaCrO 2 + CO 2 Pri zlitju z mešanico alkalij in oksidanta dobimo kromove spojine v oksidacijskem stanju (+6): Cr 2 O 3 + 4KOH + KClO 3 → 2K 2 CrO 4 + KCl + 2H 2 O Krom (III) hidroksid C r (OH) 3. amfoterni hidroksid. Sivo-zelena, pri segrevanju se razgradi, izgubi vodo in nastane zelena metahidroksid CrO(OH). Ne raztopi se v vodi. Iz raztopine se obori kot sivo-modri in modrikasto-zeleni hidrat. Reagira s kislinami in alkalijami, ne vpliva na amoniak hidrat. Ima amfoterne lastnosti - raztopi se tako v kislinah kot v alkalijah: 2Cr(OH) 3 + 3H 2 SO 4 → Cr 2 (SO 4) 3 + 6H 2 O Cr(OH) 3 + ZH + = Cr 3+ + 3H 2 O Cr (OH) 3 + KOH → K, Cr (OH) 3 + ZON - (konc.) \u003d [Cr (OH) 6] 3- Cr (OH) 3 + KOH → KCrO 2 + 2H 2 O Cr (OH) 3 + MON = MCrO 2 (zeleno) + 2H 2 O (300-400 ° C, M \u003d Li, Na) Cr(OH) 3 →(120 o C – H 2 O) CrO(OH) →(430-1000 0 С –H 2 O) Cr2O3 2Cr(OH) 3 + 4NaOH (konc.) + ZN 2 O 2 (konc.) \u003d 2Na 2 CrO 4 + 8H 2 0 Potrdilo o prejemu: obarjanje z amoniakovim hidratom iz raztopine kromovih(III) soli: Cr3+ + 3(NH3H2O) = IZr(OH) 3 ↓+ ЗНН 4+ Cr 2 (SO 4) 3 + 6NaOH → 2Cr(OH) 3 ↓+ 3Na 2 SO 4 (v presežku alkalije - oborina se raztopi) Kromove soli (III) imajo vijolično ali temno zeleno barvo. Po kemijskih lastnostih spominjajo na brezbarvne aluminijeve soli. Cr(III) spojine lahko kažejo tako oksidativne kot redukcijske lastnosti: Zn + 2Cr +3 Cl 3 → 2Cr +2 Cl 2 + ZnCl 2 2Cr +3 Cl 3 + 16NaOH + 3Br 2 → 6NaBr + 6NaCl + 8H 2 O + 2Na 2 Cr +6 O 4 Heksavalentne kromove spojine Krom (VI) oksid CrO 3 - svetlo rdeči kristali, topni v vodi. Pripravljeno iz kalijevega kromata (ali dikromata) in H 2 SO 4 (konc.). K 2 CrO 4 + H 2 SO 4 → CrO 3 + K 2 SO 4 + H 2 O K 2 Cr 2 O 7 + H 2 SO 4 → 2CrO 3 + K 2 SO 4 + H 2 O CrO 3 - kisli oksid, tvori rumene kromate CrO 4 2- z alkalijami: CrO 3 + 2KOH → K 2 CrO 4 + H 2 O V kislem okolju se kromati spremenijo v oranžne dikromate Cr 2 O 7 2-: 2K 2 CrO 4 + H 2 SO 4 → K 2 Cr 2 O 7 + K 2 SO 4 + H 2 O V alkalnem okolju ta reakcija poteka v nasprotni smeri: K 2 Cr 2 O 7 + 2KOH → 2K 2 CrO 4 + H 2 O Kalijev dikromat je oksidant v kislem okolju: K 2 Cr 2 O 7 + 4H 2 SO 4 + 3Na 2 SO 3 \u003d Cr 2 (SO 4) 3 + 3Na 2 SO 4 + K 2 SO 4 + 4H 2 O K 2 Cr 2 O 7 + 4H 2 SO 4 + 3NaNO 2 = Cr 2 (SO 4) 3 + 3NaNO 3 + K 2 SO 4 + 4H 2 O K 2 Cr 2 O 7 + 7H 2 SO 4 + 6KI = Cr 2 (SO 4) 3 + 3I 2 + 4K 2 SO 4 + 7H 2 O K 2 Cr 2 O 7 + 7H 2 SO 4 + 6FeSO 4 = Cr 2 (SO 4) 3 + 3Fe 2 (SO 4) 3 + K 2 SO 4 + 7H 2 O Kalijev kromat K 2 Kr Približno 4 . Oksosol. Rumena, nehigroskopna. Topi se brez razgradnje, toplotno stabilen. Zelo topen v vodi rumena barva raztopine ustreza ionu CrO 4 2-, rahlo hidrolizira anion. V kislem okolju prehaja v K 2 Cr 2 O 7. Oksidacijsko sredstvo (šibkejše od K 2 Cr 2 O 7). Vstopi v reakcije ionske izmenjave. Kvalitativna reakcija na ion CrO 4 2- - obarjanje rumene oborine barijevega kromata, ki se razgradi v močno kislem okolju. Uporablja se kot jedkalo za barvanje tkanin, strojenje usnja, selektivno oksidacijsko sredstvo in reagent v analizni kemiji. Enačbe najpomembnejših reakcij: 2K 2 CrO 4 + H 2 SO 4 (30 %) = K 2 Cr 2 O 7 + K 2 SO 4 + H 2 O 2K 2 CrO 4 (t) + 16HCl (konc., horizont) \u003d 2CrCl 3 + 3Cl 2 + 8H 2 O + 4KCl 2K 2 CrO 4 +2H 2 O+3H 2 S=2Cr(OH) 3 ↓+3S↓+4KOH 2K 2 CrO 4 +8H 2 O+3K 2 S=2K[Сr(OH) 6]+3S↓+4KOH 2K 2 CrO 4 + 2AgNO 3 \u003d KNO 3 + Ag 2 CrO 4 (rdeča) ↓ Kvalitativni odziv: K 2 CrO 4 + BaCl 2 \u003d 2KSl + BaCrO 4 ↓ 2ВаСrO 4 (t) + 2НCl (razb.) = ВаСr 2 O 7(p) + ВаС1 2 + Н 2 O Potrdilo o prejemu: sintranje kromita s pepeliko na zraku: 4(Cr 2 Fe ‖‖)O 4 + 8K 2 CO 3 + 7O 2 = 8K 2 CrO 4 + 2Fe 2 O 3 + 8СO 2 (1000 °С) Kalijev dikromat K 2 Kr 2 O 7 . Oksosol. tehnično ime chrompeak. Oranžno rdeča, nehigroskopna. Brez razgradnje se topi, pri nadaljnjem segrevanju se razgradi. Zelo topen v vodi oranžna barva raztopine ustreza ionu Cr 2 O 7 2-). V alkalnem mediju tvori K 2 CrO 4 . Tipičen oksidant v raztopini in pri taljenju. Vstopi v reakcije ionske izmenjave. Kvalitativne reakcije- modro obarvanje raztopine etra v prisotnosti H 2 O 2, modro obarvanje vodne raztopine pod delovanjem atomskega vodika. Uporablja se kot strojilo usnja, jedlo za barvanje tkanin, sestavina pirotehničnih sestavkov, reagent v analitski kemiji, inhibitor kovinske korozije, pomešan s H 2 SO 4 (konc.) - za pomivanje kemične posode. Enačbe najpomembnejših reakcij: 4K 2 Cr 2 O 7 \u003d 4K 2 CrO 4 + 2Cr 2 O 3 + 3O 2 (500-600 o C) K 2 Cr 2 O 7 (t) + 14HCl (konc) \u003d 2CrCl 3 + 3Cl 2 + 7H 2 O + 2KCl (vrenje) K 2 Cr 2 O 7 (t) + 2H 2 SO 4 (96 %) ⇌ 2KHSO 4 + 2CrO 3 + H 2 O (»mešanica kroma«) K 2 Cr 2 O 7 +KOH (konc) \u003d H 2 O + 2K 2 CrO 4 Cr 2 O 7 2- + 14H + + 6I - \u003d 2Cr 3+ + 3I 2 ↓ + 7H 2 O Cr 2 O 7 2- + 2H + + 3SO 2 (g) \u003d 2Cr 3+ + 3SO 4 2- + H 2 O Cr 2 O 7 2- + H 2 O + 3H 2 S (g) \u003d 3S ↓ + 2OH - + 2Cr 2 (OH) 3 ↓ Cr 2 O 7 2- (konc) + 2Ag + (razb.) \u003d Ag 2 Cr 2 O 7 (tako rdeče) ↓ Cr 2 O 7 2- (razb.) + H 2 O + Pb 2+ \u003d 2H + + 2PbCrO 4 (rdeča) ↓ K 2 Cr 2 O 7 (t) + 6HCl + 8H 0 (Zn) \u003d 2CrCl 2 (syn) + 7H 2 O + 2KCl Račun: obdelava K 2 CrO 4 z žveplovo kislino: 2K 2 CrO 4 + H 2 SO 4 (30 %) = K 2Kr 2 O 7 + K 2 SO 4 + H 2 O
|
| Preberite: |
|---|
priljubljeno:
Divji stepski konji: tarpani Tarpan žival
|
Novo
- Pomen imena Katya (Ekaterina) za dekle: značaj in usoda, izvor imena
- Zakaj nimate sreče v življenju: energetski vzroki za neuspehe in težave
- V življenju imam nenehno nesrečo, ali sem lahko poškodovan?
- Kaj so sanje o majhni miški ali veliki, veliko majhnih miši?
- Poslovni načrt - proizvodnja sokov: izračun stroškov, potrebna oprema in zahteve SES za proizvodnjo sadnih in zelenjavnih sokov
- Ljubezenski horoskop glede na znake zodiaka
- Pametna kot kamilica: najbolj natančen cvetlični horoskop
- Zakaj opica sanja Zakaj opica joče
- Razlaga sanj o ribah, zakaj ribe sanjajo v sanjah
- Kako se znebiti dolgov: zarote, molitve, obredi